El Grupo de Inmunobiología Hepática e Intestinal de la Universidad Miguel Hernández de Elche (UMH) ha identificado una estrategia eficaz para reducir el daño estructural del hígado y mejorar la función de los vasos sanguíneos hepáticos en un modelo experimental de cirrosis en ratón. El estudio, publicado recientemente en la revista científica Biomedicine & Pharmacotherapy, permite además identificar un mecanismo inflamatorio clave implicado en el desarrollo de esta enfermedad, que causa más de un millón de muertes al año en todo el mundo.
La investigación ha sido liderada por el profesor del Departamento de Medicina Clínica de la UMH, Rubén Francés Guarinos, y se ha desarrollado en colaboración con el Instituto de Investigación, Desarrollo e Innovación en Biotecnología Sanitaria de Elche (IDiBE), el Grupo de Biología Vascular Hepática del Hospital Clínic de Barcelona y el Centro de Investigación Biomédica en Red en Enfermedades Hepáticas y Digestivas (CIBERehd).
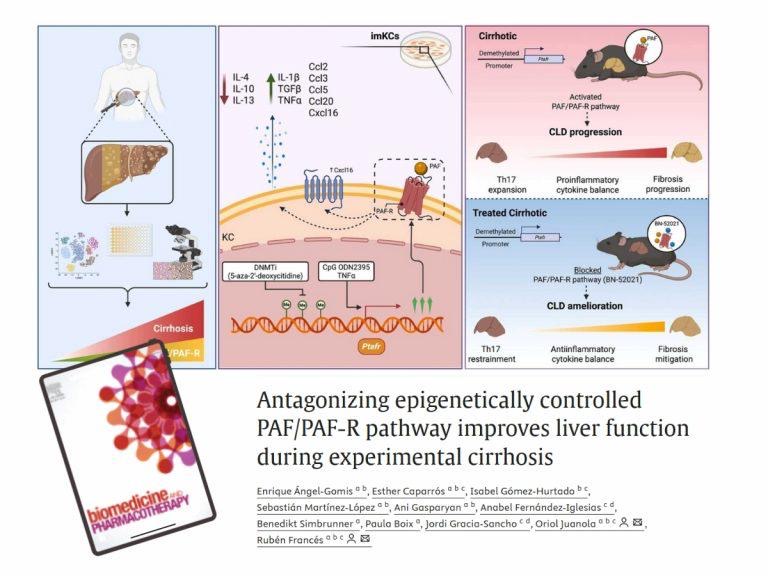
“El objetivo principal era comprender el papel del Factor Activador de Plaquetas (PAF) y de su receptor (PAF-R) en la cirrosis hepática, una enfermedad caracterizada por un daño progresivo del hígado y una inflamación crónica intensa”, explica Francés. El equipo evaluó también si el bloqueo de esta molécula inflamatoria podía convertirse en una estrategia terapéutica eficaz para mejorar la función del hígado cirrótico.
La cirrosis hepática es una patología grave y progresiva en la que el tejido hepático se cicatriza de forma irreversible, lo que conduce a la pérdida de su estructura y función. A nivel global, se asocia a cerca del 2,4 % de todas las muertes, mientras que en España provoca alrededor de 5 fallecimientos por cada 100.000 habitantes. Más allá de la mortalidad, la enfermedad conlleva numerosas complicaciones, como infecciones, hemorragias o deterioro cognitivo, que afectan de forma significativa a la calidad de vida de los pacientes.
Según explica el investigador de la UMH, las opciones terapéuticas actuales son limitadas y suelen centrarse en tratar las consecuencias de la enfermedad, más que en corregir los mecanismos biológicos que originan el daño hepático. Por ello, resulta fundamental avanzar en el conocimiento de los procesos que sostienen la inflamación crónica y la progresión de la cirrosis.
Para ello, los investigadores compararon distintos tratamientos experimentales en muestras de tejido hepático sano y cirrótico. En concreto, utilizaron el antagonista del PAF BN-52021, que bloquea el receptor PAF-R, y un inhibidor denominado Aza, que actúa sobre el control genético del receptor. El estudio incluyó análisis avanzados, como el examen de la metilación del ADN, para comprender por qué el receptor PAF-R aumenta de forma anómala en la cirrosis.
El trabajo se llevó a cabo tanto en muestras de pacientes con cirrosis, para confirmar la relevancia clínica del mecanismo, como en un modelo experimental en ratón. Los análisis se centraron especialmente en los macrófagos hepáticos o células de Kupffer, células inmunes clave en la respuesta inflamatoria del hígado.
Uno de los principales hallazgos del estudio es que el aumento del receptor PAF-R en estas células se debe a un mecanismo epigenético. En la cirrosis, se produce una desmetilación del promotor del gen que codifica este receptor, lo que elimina una marca química que normalmente limita su expresión. Como consecuencia, el gen se activa de forma excesiva, se incrementa el número de receptores PAF-R y se amplifican la inflamación y el daño hepático.
Los resultados muestran también que el tratamiento con BN-52021 logra reducir el daño estructural del hígado, mejorar la función vascular hepática y reequilibrar la respuesta inmunitaria en los ratones con cirrosis.
“En conjunto, estos hallazgos indican que los fármacos capaces de bloquear la acción del PAF podrían constituir una nueva línea de tratamiento para la cirrosis hepática”, señala Enrique Ángel Gomis, investigador de la UMH y primer autor del estudio. Además, el trabajo abre la puerta al desarrollo de terapias dirigidas a corregir los mecanismos epigenéticos que regulan el receptor PAF-R, actuando sobre el origen molecular de la inflamación.
La investigación ha contado con financiación de la Agencia Estatal de Investigación, el Instituto de Salud Carlos III, la Generalitat Valenciana a través del programa PROMETEO, así como de ayudas predoctorales, la Cátedra de Cronicidad de la UMH y la Austrian Science Fund (FWF).






 Iván Hurtado
Iván Hurtado














